Posiadamy własną Pracownię Patomorfologii Zwierząt z doświadczonym i fachowym zespołem patologów weterynaryjnych oraz techników histologicznych. Prowadzimy diagnostykę patomorfologiczną zwierząt oraz współpracujemy z jednostkami naukowymi oraz badawczo-rozwojowymi w zakresie patologii doświadczalnej i zwierząt laboratoryjnych. Ściśle współpracujemy z diagnostami laboratoryjnymi i mikrobiologami zapewniając naszym klientom kompleksową diagnostykę patologiczną.
UWAGI DOTYCZĄCE BADANIA CYTOLOGICZNEGO
-
Do badania cytologicznego można przesłać (a) bioptaty cienkoigłowe z węzłów chłonnych, szpiku kostnego, narządów wewnętrznych i zmian patologicznych, (b) próbki płynów z jam ciała (jam surowiczych, stawów, płynu mózgowo-rdzeniowego), (c) płynów patologicznych (wysięk zapalny, zawartość torbieli), (d) wymazów z otworów naturalnych oraz ubytków skóry, (e) preparatów odciskowych ze skóry i powierzchni zmian patologicznych, (f) popłuczyn z drzewa oskrzelowego. W skierowaniu należy umieścić informację jaką techniką materiał był pobierany – ułatwia/umożliwia to interpretację wyniku.
-
Zdecydowanie bardziej przydatne są szkiełka mikroskopowe z matowym końcem, na którym ołówkiem (lub flamastrem odpornym na działanie alkoholu) umieszczamy informacje dla laboratorium, takie jak, lokalizacja zmiany, węzeł z którego pobrano materiał (jeżeli do badania przesyła się bioptaty z różnych węzłów) lub że materiał zawiera rozmaz bezpośredni płynu lub jego osad. W niektórych szkiełkach powierzchnia matowa znajduje się tylko po jednej stronie szkiełka, dlatego też jeżeli ma być wykorzystana do opisu to pobrany materiał należy rozmazać na tej stronie szkiełka, z której obszar do opisu jest chropowaty i umożliwia pisanie ołówkiem.
-
Jednym z warunków uzyskania dobrej jakości preparatów jest zastosowanie odpowiedniej techniki pobrania i przygotowania rozmazów, zanim zakończy się procedurę pobierania materiału, przed zapakowaniem preparatów warto sprawdzić czy rozmaz rzeczywiście zawiera materiał (jeżeli są co do tego wątpliwości należy pobrać dodatkowe próbki). Według ostatnio przeprowadzonych badań własnych dobra jakość rozmazów przed zabarwieniem przesyłanych do badania jest dodatnio skorelowana z przydatnością diagnostyczną wyniku badania cytologicznego (Sapierzyński R. i wsp. Factors affecting the diagnostic utility of canine and feline cytological samples. J. Small Anim. Pract. 2016, doi: 10.111/jasp.12598).
-
W przypadku gdy ze zmiany guzowatej pobiera się materiał płynny należy dołożyć starań aby uzyskać też próbki z litych obszarów guza (biopsję można wykonać pod kontrolą USG). Często zawarte w masie guza struktury jamiste są wypełnione płynem, który często nie zawiera materiału o przydatności diagnostycznej (jamiste obszary powstają najczęściej jako konsekwencja wylewów krwi lub rozwoju martwicy niedokrwiennej guza).
-
Jeżeli do badania przesyła się materiał płynny (np. płyny z jam ciała, płyn mózgowo-rdzeniowy) to należy umieścić go w probówce z EDTA (w innym wypadku w próbówce może powstać skrzep, co uniemożliwi wykonanie rozmazu cytologicznego dobrej jakości). Do takiego materiału należy dołączyć kilka (3-4) bezpośrednich rozmazów płynu niewirowanego oraz rozmazy z osadu (jeżeli lecznica nie dysponuje wirówką, to płyn umieszczony w probówce z EDTA można na godzinę umieścić w lodówce – nie zamrażać – następnie usunąć delikatnie płyn z nad osadu i z osadu wykonać kilka rozmazów). Inną możliwością, która może udławić ocenę cytologiczną materiału płynnego, przy braku wirówki jest wykonanie rozmazów techniką z liniową koncentracją komórek. Taka technika pozwala uzyskać na szkiełku mikroskopowym liniowy obszar bogaty w komórki, co zdecydowanie ułatwia obserwacje mikroskopową – pozwala w krótkim czasie ocenić dużą liczbę komórek zawartych w próbce.
-
Rozmazy utrwala się przez suszenie, stosowanie dodatkowych metod utrwalenia jest niewskazane (np. cytofix).
-
Należy zadbać by rozmazy w trakcie przesyłania do laboratorium nie uległy zniszczeniu. Najlepiej umieścić je w specjalnych plastikowych pojemnikach lub owinąć w papier, a następnie gruby pokład ligniny i obwiązać gumką recepturką.
-
Preparaty barwione są rutynowo odczynnikiem Giemsy (pozwala to na ocenę rozmazu w 90% przypadków), a w razie potrzeby można zastosować metody cytochemiczne (na obecność prątków, obecność grzybów, obecność ziarnistości komórek tucznych) lub immunocytochemiczne (teoretycznie na obecność tych samych antygenów jak przy badaniu immunohistochemicznym, jednak w przypadku badania preparatów cytologicznych konieczne jest przesłanie w ciągu 24 godzin nowych nieutrwalonych rozmazów cytologicznych – niestety przed barwieniem nie ma możliwości oceny czy w przesłanych rozmazach znajdują się komórki będące przedmiotem badania – dlatego też barwienie obarczone jest ryzykiem że jego wynik nie będzie informatywny) - za barwienia te pobierane są dodatkowe opłaty zgodnie z cennikiem laboratorium, dlatego też w przypadku takiej sugestii zawartej w wyniku zainteresowany lekarz kierujący winien skontaktować się z laboratorium i omówić kwestie związane z tym badaniem.
-
W przypadku zmian bogatokomórkowych (powiększone węzły chłonne), o luźnym utkaniu (śledziona), bogatych w naczynia krwionośne (raki tarczycy) lub obfitujących w obszary wylewów krwi (naczyniakomięsak) korzystne jest zastosowanie techniki biopsji cienkoigłowej bez aspiracji, w której to do badanej zmiany wprowadza się samą igłę, a strzykawki używa tylko do przeniesienia materiału z igły na szkiełko mikroskopowe. W niektórych zmianach zastosowanie strzykawki do wytworzenia podciśnienia spowoduje napływ dużej ilości krwi, co skutkuje znacznym rozrzedzeniem próbki, tworzeniem skrzepów na szkiełku lub też tworzy się gruba warstwa materiału uniemożliwiająca poprawną interpretację morfologii nielicznych komórek.
-
Pomocne w niektórych przypadkach zmian nowotworowych jest pobieranie materiału komórkowego pod kontrolą USG, (jest to wręcz rutynowe działanie w przypadku zmian guzowatych zlokalizowanych w jamach ciała) także w przypadku nowotworów skóry i tkanki podskórnej, czyli takich które widać bezpośrednio lub które można dokładnie zbadać palpacyjnie. Często miąższ guza, szczególnie dużego jest heterogenny i oprócz litych pól utworzonych z proliferujących komórek nowotworowych zawiera też obszary torbielowate lub pseudotorbielowate (spowodowane obecnością ogniskowej martwicy guza) oraz obszary wylewów krwi.
|
UWAGI DOTYCZĄCE BADANIA CYTOLOGICZNEGO MOCZU – SZCZEGÓLNIE W PRZYPADKU PODEJRZENIA NOWOTWORÓW UKŁADU MOCZOWEGO |
|
Z uwagi na autolityczne właściwości moczu, w przypadku planowanego badania cytologicznego należy mocz odwirować i wykonać rozmazy z jego osadu. Odwlekanie tej procedury sprawia, że obecne w moczu komórki ulegają nasilonym zmianom litycznym i ocena ich morfologii nie jest możliwa. Przy braku wirówki, mocz umieszczony w probówce z EDTA na godzinę umieszczamy w lodówce, następnie usuwamy delikatnie mocz z nad osadu i z osadu wykonujemy kilka rozmazów (ewentualnie z techniką z liniową koncentracją komórek, co pozwoli na uzyskanie wąskiej linii, w której znajdziemy bogatą populację komórek - patrz niżej) |
|
Jedynie u 30% psów z rakiem nabłonka przejściowego pęcherza moczowego komórki nowotworowe stwierdza się w moczu, co sprawia, że skuteczność badania cytologicznego osadu moczu w rozpoznawaniu raka pęcherza moczowego została oceniona na niską. Niestety, z powodu właściwości moczu (wysoka osmolalność, zmiany pH) pojawiają się znaczne uszkodzenie komórek uniemożliwiające ich ocenę, co więcej nie w każdym takim przypadku możliwe jest określenie, czy te komórki są w rzeczywistości komórkami nowotworowymi. Z drugiej strony atypię komórkową obserwuje się też w komórkach nabłonka przejściowego pobudzonego cytokinami w przebiegu zapalenia pęcherza moczowego, dlatego też rozpoznanie jest szczególnie trudne w przypadku, gdy oprócz atypowych komórek nabłonkowych w rozmazach obserwuje się też komórki zapalne oraz bakterie. |
|
Zwiększenie skuteczności badania cytologicznego można uzyskać, wykonując biopsję cienkoigłową masy guzowatej pęcherza moczowego – w takich przypadkach rozpoznanie cytologiczne można uzyskać w 90% przypadków. NALEŻY PAMIĘTAĆ, ŻE Z UWAGI NA MOŻLIWOŚĆ ROZSIEWU KOMÓREK NOWOTWOROWYCH NIEKTÓRZY AUTORZY ODRADZAJĄ WYKONYWANIE BIOPSJI PRZEZSKÓRNEJ – W TAKICH PRZYPADKACH MATERIAŁ NAJLEPIEJ POBRAĆ DROGĄ URAZOWEJ KATETERYACJI PRZEZ CEWKĄ MOCZOWĄ
|
CZEGO NALEŻY UNIKAĆ
-
Zlepiania rozmazów materiałem „do siebie”
-
Oklejania rozmazów plastrem
-
Przesyłania rozmazów nieoznaczonych/nieopisanych
-
Umieszczania próbek płynu w probówce „na skrzep”
-
Przesyłanie rozmazów cytologicznych w tej samej torebce co próbki zatopione w formalinie
|
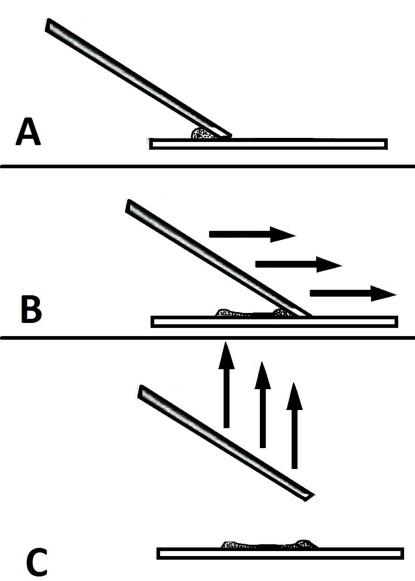
Schemat przedstawiający zasadę wykonywania rozmazów z liniowa koncentracja komórek. A – do kropli płynu znajdującego się na szkiełku podstawowym pod kątem około 45 stopni przystawia się krawędź szkiełka rozmazującego, którym będzie wykonywany rozmaz. B – szkiełko rozmazujące przesuwa się w kierunku przeciwległego końca szkiełka na której znajduje się materiał płynny – w ten sposób materiał jest rozprowadzany na szkiełku podstawowym. C- szkiełko rozmazujące odrywa się od szkiełka podstawowego i unosi prostopadle do góry – powoduje to wytworzenie linii płynu bogatej w komórki. |
|
|
UWAGI DOTYCZĄCE BADANIA HISTOLOGICZNEGO
-
Materiałem do badania histopatologicznego może być: wycinki lub całe zmiany guzowate, wycinki skóry, wycinki narządów wewnętrznych i węzłów chłonnych, bioptaty gruboigłowe (biopsja tru-cut) narządów wewnętrznych, węzłów chłonnych i zmian patologicznych.
-
Przy prawidłowo zabezpieczonym i utrwalonym materiale wynik jest przesyłany w ciągu 3-5 dni roboczych od dotarcie próbki o laboratorium. Czas ten może ulec wydłużeniu w przypadkach gdy materiał jest niewłaściwie utrwalony, wymaga odwapnienia (materiał zawierający obszary mineralizacji lub tkanki kostnej), zastosowania dodatkowych metod barwienia lub też gdy pracownik laboratorium musi wyjaśnić niejasności związane z przesłanym materiałem (np. brak informacji nt. miejsca pobrania próbki).
-
Przesłany wynik zawiera dane właściciela i zwierzęcia, przedmiot badania, opis mikroskopowy próbki, rozpoznanie histopatologiczne oraz komentarz z interpretacją obrazu histologicznego (patolog może dokonać interpretacji tylko w sytuacji gdy dysponuje skierowaniem zawierającym stosowne informacji dotyczące danego przypadku).
-
Próbki do badań histopatologicznych powinny być pobrane za pomocą odpowiedniej techniki i umieszczone w utrwalaczu (buforowanej 10% formalinie, czyli 4% wodnym roztworze formaldehydu) w odpowiedniej wielkości naczyniu.
-
Odpowiednie duże naczynie umożliwia zalanie próbki odpowiednią objętością utrwalacza (idealnie jest gdy objętość utrwalacza do objętości tkanki wynosi 10:1), zapobiegnie zdeformowaniu próbki (zbyt małe naczynie sprawia, że próbka zostaje wciśnięta do naczynia, co powoduje jej odkształcenie, deformacje i uniemożliwia orientację odnośnie jej położenia w narządzie oraz wycięcie odpowiednio zorientowanych wycinków, a ponadto przyczynia się do powstawania artefaktów), a odpowiedniej wielkości otwór umożliwia bezproblemowe wyjęcie próbki z naczynia (w związku z tym że w formalinie tkanki sztywnieją i pęcznieją to to co udało się wcisnąć do naczynia przez wąski otwór nie zawsze udaje się z owego naczynia wyjąć).
-
Naczynie z utrwalaczem powinno być szczelnie zakręcone, umieszczone w foliowej torbie i zabezpieczone przed uszkodzeniem (lepsze są pojemniki plastikowe niż szklane). W przypadku większych zmian (np. resekowana śledziona) próbkę można wstępnie utrwalić przez 2-3 dni 2 formalinie, a następnie umieścić w szczelnej foliowej torbie, zabezpieczyć przed uszkodzeniem i przesłać do laboratorium.
-
Duże próbki należy ponacinać, aby umożliwić dyfuzję formaliny do dużych obszarów, odnosi się to szczególnie do struktur posiadających torebkę włóknistą (nerka, jądro). W przypadku dużych próbek można też pobrać próbki reprezentatywne i przesłać materiału do laboratorium, a resztę zabezpieczyć i przechować do momentu uzyskania rozpoznania histologicznego.
-
W przypadku zmian mnogich należy je umieścić w oddzielnych naczyniach z utrwalaczem i odpowiednio oznaczyć, lub umieścić w jednym naczyniu ale w odpowiedni sposób oznaczyć, np. dwie nitki oznaczają guz skóry z przedramienia, a wycinek z jedną nitką oznacza guz skóry pobrany z karku)
-
Skrawki bada się po zabarwieniu ich metodą hematoksylina-eozyna (co umożliwia rozpoznanie w 70-80% przypadków), a w razie konieczności metodami dodatkowymi, np. metodami histochemicznymi (barwienie w kierunku obecności prątków, grzybów, włókien tkanki łącznej, ziarnistości komórek tucznych – za barwienia te nie są pobierane dodatkowe opłaty) lub metodami immunohistochemicznymi (najczęściej barwienia na obecność ekspresji: cytokeratyny – marker pochodzenia nabłonkowego, wimentyny – marker pochodzenia mezenchymalnego, desmina – marker tkanki mięśniowej, MelanA – marker melanocytów i melanoblastów, CD3 – limfocyty T, CD20-limfocyty B, CD34-marker blastycznych komórek limfoidalnych i hematopoetycznych; CD68 – marker makrofagów; za barwienia te pobierane są dodatkowe opłaty zgodnie z cennikiem laboratorium, dlatego też w przypadku takiej sugestii zawartej w wyniku zainteresowany lekarz kierujący winien skontaktować się z laboratorium i omówić kwestie związane z tym badaniem)
-
Istotne z punktu widzenia patologa jest czy przesłany materiał zawiera całą zmianę, czy jej wycinek.
-
W przypadku zmian nowotworowych oprócz określenia typu histologicznego oraz złośliwości nowotworu wynik zawiera też te cechy mikroskopowe, które mają wartość rokowniczą (jedynie w tych przypadkach gdy takie parametry zostały określone jako przydatne dla danych typów zmian) lub przydatną przy planowaniu postępowania z pacjentem.
-
Ocena doszczętności zabiegu chirurgicznego w niektórych przypadkach ma większe znaczenia dla pacjenta niż samo rozpoznanie. W przypadku niewielkich zmian skórnych/podskórnych możliwe dokładne zbadanie wszystkich marginesów, w czym pomaga oznaczanie marginesów tuszem. W przypadku zmian większych oznaczanie konieczne może być oznaczenie WYBRANYCH MARGINESÓW (marginesów „podejrzanych”) za pomocą tuszu, igieł lub nitek chirurgicznych z jednoczesnym opisem, co o w jaki sposób zostało oznaczone (np. jeden węzełek – margines doczaszkowy, dwa węzełki – margines doogonowy; tusz żółty – marginesy boczne, tusz zielony – margines dolny). Zdecydowanie bardziej korzystne jest „tuszowanie” resektu tuż po zabiegu (preferowany czas do 30 minut od resekcji), na nieutrwalonej tkance, przez operatora, które zmianę wycinał i jest najlepiej zorientowany odnośnie jej umiejscowienia. Możliwe jest też oznaczanie tuszem na materiale utrwalonym jednak, ze względu na artefakty związane z utrwaleniem (obkurczenie się próbki i jej skręcenie) taka procedura może powodować powstanie zafałszowań. Przed barwieniem materiał należy osuszyć z nadmiaru płynów (w tym formaliny), a następnie zastosować tusz wodoodporny, przeznaczony do tego celu i za pomocą gazika lub wacika zabarwić tylko te obszary, które mają być zbadane. W dalszej kolejności należy umożliwić wyschnięcie tuszu (około 5-10 minut, zapobiegnie to wypłukaniu tuszu z tkanek przez formalinę) i umieścić resekt w utrwalaczu. Jeżeli wycinek jest duży to w pierwszej kolejności należy oznaczyć marginesy, umożliwić wyschnięcie tuszu, a następnie materiał pokroić na mniejsze fragmenty (W uzasadnionych przypadkach marginesy chirurgiczne można oddzielić od głównej masy guza i przesłać je w oddzielnym naczyniu (oznaczonym „marginesy chirurgiczne”), jednak wąskie paski tkanki często ulegają skręceniu i trudno jest uzyskać z nich dobrej jakości preparat histopatologiczny – nie jest to preferowana metoda oceny marginesów).
Badanie całej zmiany po resekcji chirurgicznej ma na celu określenie:
-
precyzyjnego rozpoznania typu nowotworu i stopnia jego złośliwości (om ile został opracowany) – rozpoznanie ostateczne, możliwe w zdecydowanej większości przypadków, chociaż niekiedy wymaga stosowania barwień dodatkowych, niekiedy rozpoznanie histologiczne nie jest jednoznaczne (np. zmiana niezłośliwa z obszarami atypii komórkowej),
-
oceny doszczętności zabiegu chirurgicznego – ocena marginesów chirurgicznych – pewny jest jedynie wynik dodatni (komórki nowotworowe obecne na linii cięcia), wynik ujemny (komórki nowotworowe nie widoczne na linii cięcia) może nie być zgodny z prawdą (ocena wszystkich brzegów nie zawsze jest możliwa),
-
oceny ewentualnego rozsiewu choroby nowotworowej – ocena zajęcia naczyń krwionośnych i chłonnych, nerwów, węzłów chłonnych - pewny jest jedynie wynik dodatni (komórki nowotworowe w naczyniach),
-
ocena parametrów o znaczeniu rokowniczym i terapeutycznych – o ile istnieją - u zwierząt jak dotąd opracowano takie parametry tylko w przypadku niektórych nowotworów.
|
UWAGI DO BARWIENIA IMMUNOHISTOCHEMICZNEGO/IMMUNOCYTOCHEMICZNEGO
|
|
|
Barwienie tego służy do wykrywania konkretnych antygenów (Ag) w badanych tkankach. Próbka jest barwiona specyficznymi przeciwciałami (Ab), które rozpoznają konkretny antygen, a technika barwienia umożliwia wykazanie miejsca reakcji znanego przeciwciała z szukanym antygenem (brązowa barwa). Barwienie to najczęściej wykorzystuje się przy ocenie pochodzenia komórek lub niektóre antygeny o wartości rokowniczej lub przydatne przy planowaniu leczenia, stosując poniższe przeciwciała |
|
|
Stosowane przeciwciało/poszukiwany antygen |
Charakterystyka poszukiwanego antygenu |
|
Cytokeratyna Wimentyna Desmina MelanA CD3 CD11/CD18, CD68 CD20, CD21, CD79alfa, Pax5 CD34
CD117 (c-KIT) Aktyna Chromogranina, synaptofizyna ER – receptory estrogenowe Ki67 Podoplanina S-100 TTF-1 |
marker komórek nabłonka marker komórek mezenchymalnych marker tkanki mięśniowej marker melanocytów, melanoblastów marker limfocytów T markery histiocytów/makrofagów markery limfocytów B marker komórek blastycznych, komórek śródbłonka
receptor kinazy tyrozynowej marker mięśni gładkich markery komórek endokrynowych obecność receptorów estrogenowych ocena aktywności proliferacyjnej komórek marker podocytów komórki układu nerwowego, komórki czerniaka pierwotne raki płuc i tarczycy |
|
W przypadku gdy wskazane może być barwienie immunohistochemiczne materiał nie może zbyt długo przebywać w formalinie – powoduje to zmiany dotyczące antygenów, co sprawia, że reakcja Ag-Ab może nie wystąpić. W związku z dość dużym kosztem barwienia, sugestia o konieczności zastosowania barwienia immunohistochemicznego jest wskazana przez patologa po badaniu histopatologicznym preparatów barwionych metodą przeglądową jeżeli wynik nie jest jednoznaczny. Decyzję o wykonaniu barwienia potwierdza lekarz kierujący poprzez zgłoszenie tego faktu do laboratorium. |
|
|
Barwienie immunocytochemiczne można przeprowadzić też wykorzystując rozmazy cytologiczne np. pobrane od pacjentów z rozpoznanym chłoniakiem (określenie immunofenotypu chłoniaka – chłoniaki B lub T komórkowe). Preparaty należy wysuszyć i powinny się one znaleźć w laboratorium w przeciągu 24 godzin. Co więcej, oprócz rozmazów do rutynowego barwienia cytologicznego należy dostarczyć kilka (2-3) dodatkowych rozmazów przeznaczonych do barwienia immunocytochemicznego. Niestety, w przypadku barwienia immunocytochemicznego mogą pojawić się czynniki skutkujące wynikami fałszywie ujemnymi (reakcje jest ujemna pomimo obecności poszukiwanego antygenu). Barwieniu poddaje się preparaty wcześniej niebarwione, w związku z tym nie wiadomo czy na rozmazie w ogóle znajdują się jakiekolwiek dobrze zachowane komórki, które można poddać barwieniu – dlatego też wynik barwienia może nie być rozstrzygające |
|